
一种具有完善的微孔阵列和简单的双层结构的微流控系统,可以大规模制造多尺寸的三维仿生肿瘤,并同时进行操作和正交分析。
Introduction
有效的生物仿生肿瘤系统的建立,用于细致地探索肿瘤病理学和治疗,一直是人们感兴趣和广泛研究的课题。三维(3D)肿瘤培养已被认为是一种改进的体外模型,可以更好地模拟体内的实际肿瘤的生物学特性(例如,复杂的细胞组织和相互作用;与营养、增殖、代谢和生存能力相关的化学和表型梯度),并克服了不自然的粘附和常规二维(2D)细胞单层培养物排列方式的负面影响。一个广泛的共识表明体外3D肿瘤培养提供了更合适的临床模型以评估药物对实体瘤的有效性以及更可信和有意义的治疗数据以减少对病人的潜在危险。
建立具有同时、通量(即大规模)和可控制操作多尺寸3D肿瘤的能力的肿瘤芯片以及它们涉及多浓度药物耐药性的评估在很大程度上仍然遥不可及。因此作者提出了一种微流控方法,用于同时大量生产多种尺寸的3D肿瘤,以及在多种抗癌药物治疗期间,监测不同流体微环境中的肿瘤反应。
Fig. 1. Microfluidic platform for multi-size 3D tumor production

- (A)有8个平行小室(每个小室中有多个尺寸的微孔阵列)的微流控装置。
- (B)有着通用直径设计的微孔阵列示意图。
- (C)3D肿瘤培养操作的示意图。
Fig. 2. Microfluidic cell localization in the microwells with different diameters
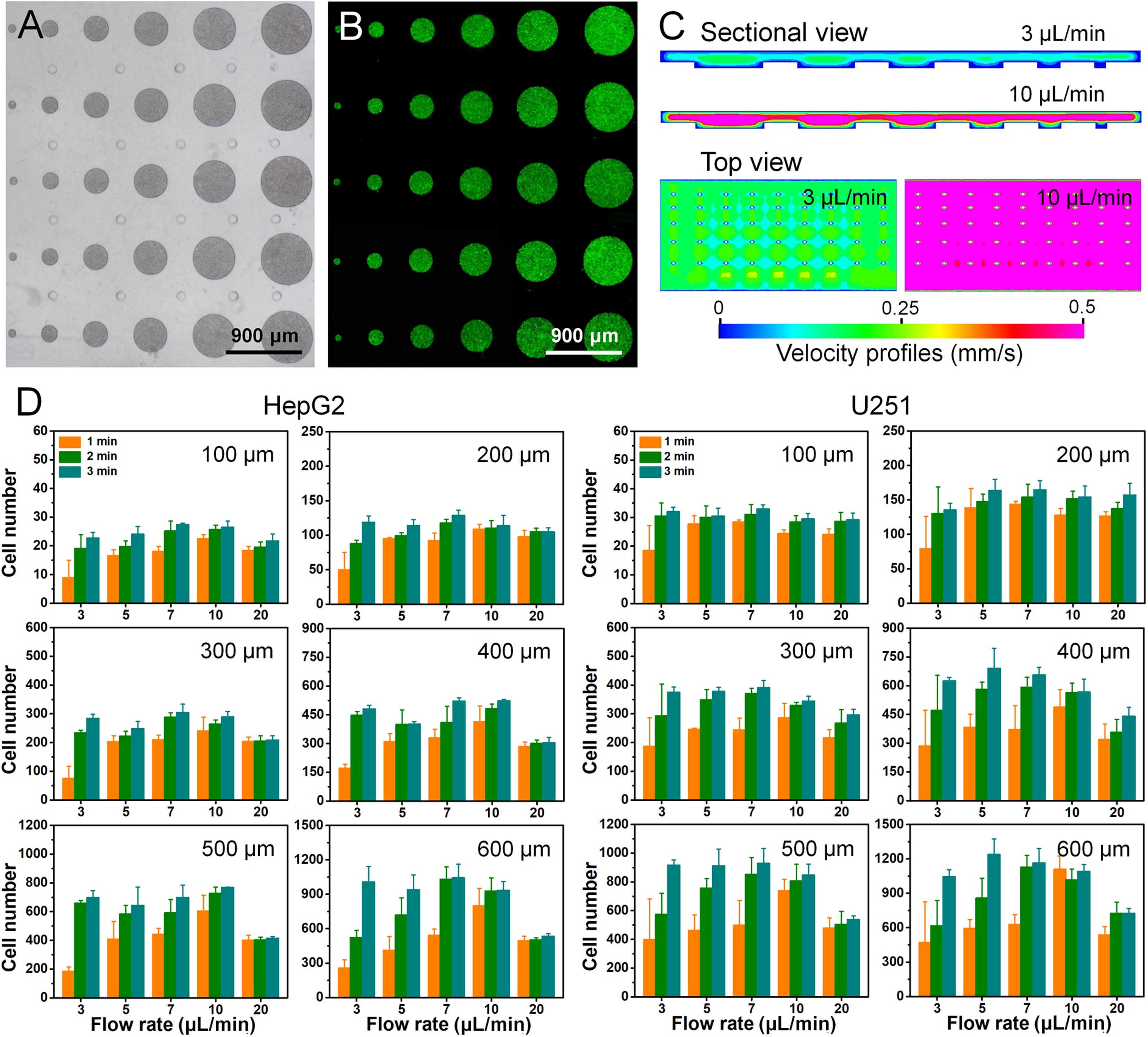
- (A)HepG2细胞捕获阵列的光学图像。
- (B)与(A)对应的捕获细胞荧光图像。细胞用CellTracker Green预染以可视化。
- (C)模拟的不同流速(3和10 μL/min)在装置中的流体环境。
- (D)各种流速(3、5、7、10和20 μL/min)和不同的装载时间(1、2和3 min)下,不同微孔中捕获细胞的定量。
Fig. 3. Multi-size 3D tumor production in the microfluidic platform

不同大小的HepG2和U251肿瘤在各自的微孔中4天的培养中逐渐形成。
Fig. 4. Evaluation of tumor cultivation in the device
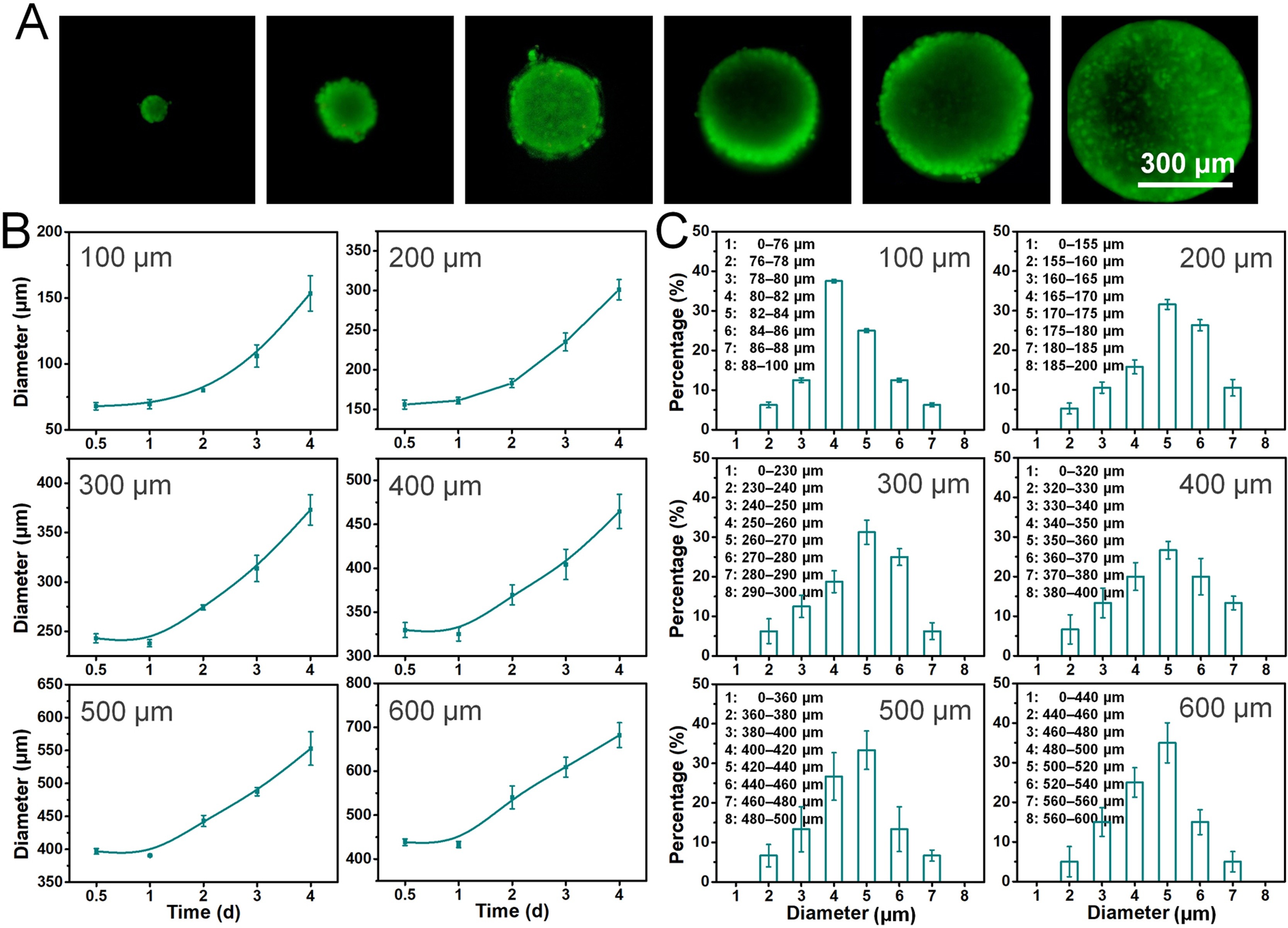
- (A)多尺寸HepG2肿瘤的细胞活性。活/死(绿/红)细胞通过FDA/PI染色可视化。
- (B)微孔中不同直径(100-600 μm)的HepG2肿瘤生长。
- (C)微孔中培养2天的多尺寸HepG2肿瘤的不同直径大小分布。
Fig. 5. Microfluidic chemotherapy in multi-size 3D HepG2 tumors

两种具有不同浓度(50、100、200和300 μM)的抗癌药物博来霉素和替拉扎明(BLM和TPZ)用于评估不同大小肿瘤的化学敏感性。保持药物刺激3天,并相应地设置对照培养物。通过FDA/PI染色可观察活/死(绿色/红色)细胞。
Fig. 6. Therapeutic efficacy of anticancer drugs with different concentrations (50, 100, 200, and 300 μM)) in multi-size 3D tumors
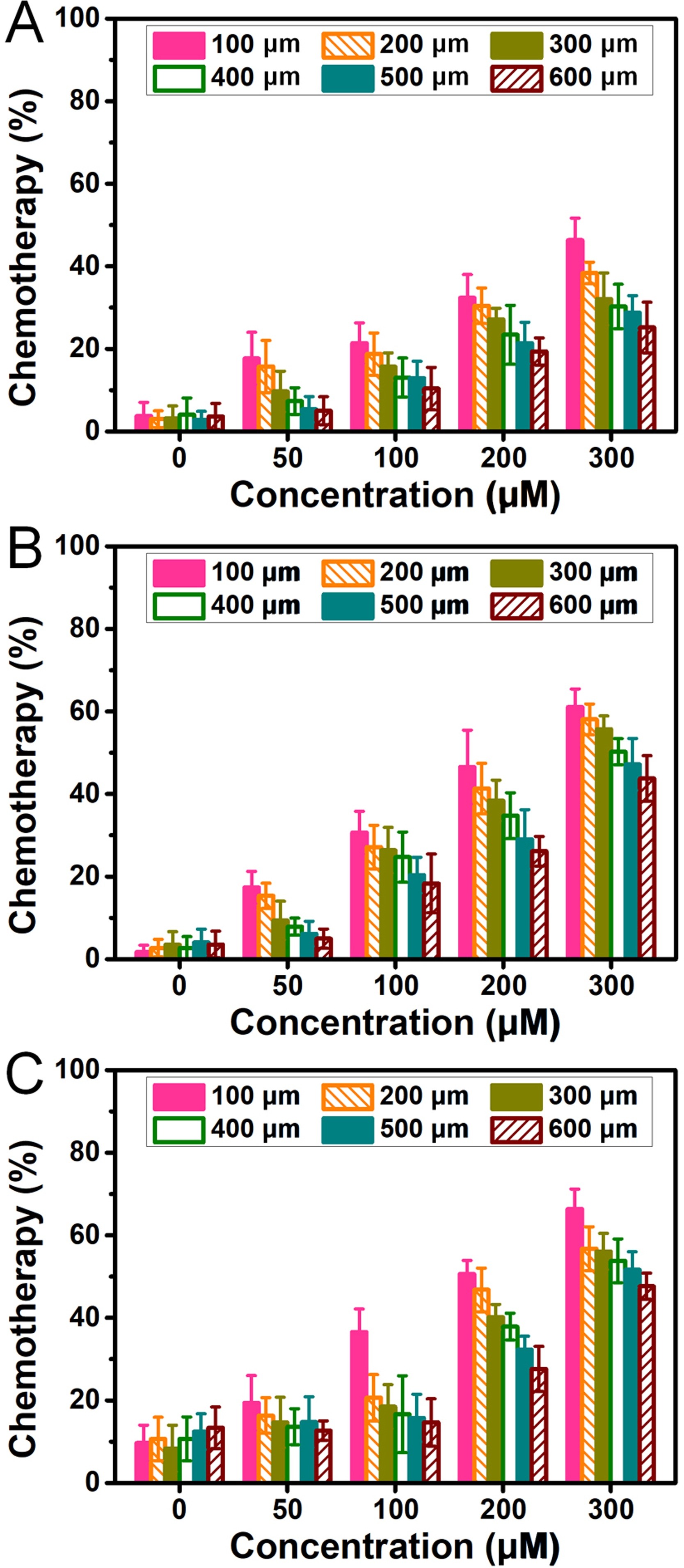
- (A)BLM处理的微孔中的HepG2肿瘤的不同直径(100-600 μm)。
- (B)TPZ处理的微孔中的HepG2肿瘤的不同直径。
- (C)BLM处理的微孔中的U251肿瘤的不同直径。纵轴化疗(率)对应于细胞死亡的百分比。
Conclusion
开发了一种简便、大规模且可控制的生产过程,可使用简单,完善的微流控系统同时生成多种尺寸的仿生3D肿瘤。该结果支持了在研究肿瘤治疗和化疗敏感性时,具有复杂组织微环境的3D肿瘤的大小和组成的重要性。
Reference
Liu W, Sun M, Lu B, et al. A microfluidic platform for multi-size 3D tumor culture, monitoring and drug resistance testing[J]. Sensors and Actuators B: Chemical, 2019, 292: 111–120.




